Pitipeptolidy:
cyklodepsipeptidy mořské cyanobakterie Lybgbya
majuscula
Jiří
Patočka
Mořská cyanobakterie Lybgbya majuscula je neobyčejně bohatým zdrojem sekundárních metabolitů rozličných chemických struktur. Jednou z nich jsou i cyklické peptidy a depsipeptidy, tedy peptidy v nichž jsou některé peptidické vazby nahrazeny vazbami esterovými. Zdá se, že některé sekundární metabolity jsou jedinečné pro konkrétní kolekce bakterií. Takovými metabolity jsou cyklodepsipeptidy cyanobakterie Lyngbya majuscula shromážděné u oblasti Piti Bomb Holes na ostrově Guam, které byly pojmenovány pitipetolidy (Luesch et al., 2001). Jejich struktury byly objasněny spektroskopickými technikami a charakterizací degradačních produktů. Obsahují neobvyklé aminokyseliny, např. kyselinu 2,2-dimethyl-3-hydroxy-7-oktinovou nebo kyselinu 2,2-dimethyl-3-hydroxy-7-oktenovou. Pitipeptolidy A (1) a B (2) vykazují slabou cytotoxicitu proti rakovinným buňkám LoVo, avšak vykazují také mírnou antimykobakteriální aktivitu a stimulují aktivitu elastázy (Luesch et al., 2001).
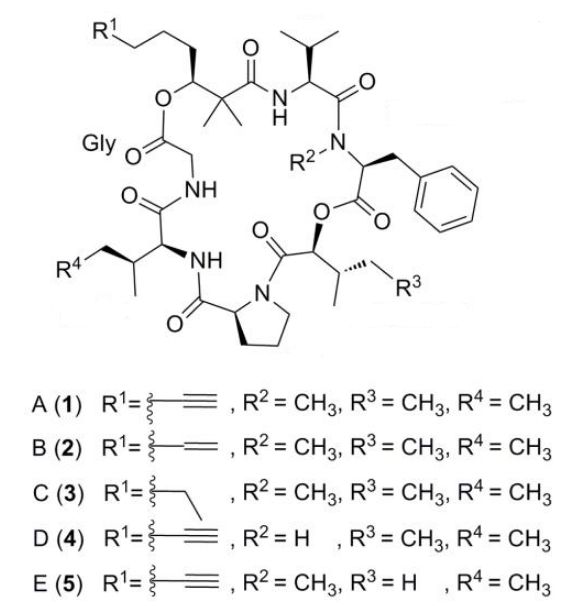
Pitipeptolid A je hlavním sekundárním metabolitem cyanobakterie Lyngbya majuscula z Guamu. Jak prokázali Cruz-Rivera a Paul (2007), pitipeptolid A je také hlavní defenzivní molekulou, která má za úkol odrazovat bezobratlé živočichy od konzumace této cyanobakterie.
Další analogy pitipeptolidů byly izolovány Montaserem et al. (2011). Čtyři identifikované analogy, pitipeptolidy C - F (3-6), jsou tetrahydro analog (3), analog s nižším stupněm methylace (4) a dva jsou homology (5 a 6) pitipeptolidu A. Jejich struktury byly objasněny za použití 2D NMR spekter, chirální HPLC analýzy a porovnáním s pitipeptolidem A. Identifikované analogy vykazovaly slabší cytotoxické aktivity ve srovnání s dvěma hlavními výchozími sloučeninami, pitipeptolidy A (1) a B (2), proti adenokarcinomu prsu HT-29 a MCF7 buňkám karcinomu prsu. Naopak pitipeptolid F (6) byl nejúčinnějším pitipeptolidem proti Mycobacterium tuberculosis. Tato zjištění naznačují, že vhodnou obměnou struktury pitipeptolidů je možné řídit antibakteriální aktivitu a optimalizovat její selektivitu.
Literatura
Cruz-Rivera E, Paul VJ. Chemical deterrence of a cyanobacterial metabolite against generalized and specialized grazers. J Chem Ecol. 2007; 33(1): 213-217.
Luesch H, Pangilinan R, Yoshida WY, Moore RE, Paul VJ. Pitipeptolides A and B, new cyclodepsipeptides from the marine cyanobacterium Lyngbya majuscula. J Nat Prod. 2001; 64(3): 304-307.
Montaser R, Paul VJ, Luesch H. Pitipeptolides C-F, antimycobacterial cyclodepsipeptides from the marine cyanobacterium Lyngbya majuscula from Guam. Phytochemistry. 2011; 72(16): 2068-2074.